 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
电极反应,=+1.36V,故,=×1.36V。()
电极反应 ,
,
 ,
,

 答案
答案
 请输入或粘贴题目内容
搜题
请输入或粘贴题目内容
搜题
 拍照、语音搜题,请扫码下载APP
拍照、语音搜题,请扫码下载APP
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
电极反应 ,
,
 ,
,

 答案
答案
 更多“电极反应,=+1.36V,故,=×1.36V。()”相关的问题
更多“电极反应,=+1.36V,故,=×1.36V。()”相关的问题
第1题
B.标准状态下,MnO4-的氧化性比Cl2强,因为在电极反应中MnO4-得到的电子多
C.已知电极反应Cl2+2e-→2Cl-的φθ=1.36V,则电极反应1/2Cl2+e-→Cl-的φθ=0.68V
D.CrO42-和Cr2O72-两离子中Cr的氧化值相等
第2题
已知Eθ(MnO-4/Mn2+)=1.51V,Eθ(Cl2/Cl-)=1.36V,若将此两电对组成原电池,请写出:
(1)该电池的电池符号;
(2)写出正负电极的电极反应和电池反应以及电池标准电动势;
(3)计算电池反应在25℃时和Kθ;
(4)当[H+] = 1.0×10-2mol•L-1,而其他离子浓度均为1.0 mol•L-1,= 100 kPa时的电池电动势.
第3题
已知EΘ(Cl2/Cl-)=1.36V和酸性溶液中钛的元素电势图为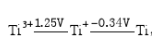 ,则在水溶液中Ti+______发生歧化反应。当金属钛与H+(aq)发生反应时,得到______离子,其反应方程式为______;在溶液中Cl2与Ti反应的产物是______。
,则在水溶液中Ti+______发生歧化反应。当金属钛与H+(aq)发生反应时,得到______离子,其反应方程式为______;在溶液中Cl2与Ti反应的产物是______。
第4题
298K时,以Pt为阳极,Fe为阴极,电解浓度为1mol·kg-1的NaCl水溶液(活度因子为0.66)。设电极表面有H2(g)不断逸出时的电流密度为0.1A·cm-2,Pt逸出Cl2(g)的超电势可近似视为零。若Tafel公式为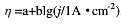 ,且Tafel常数a=0.73V,b=0.11V,
,且Tafel常数a=0.73V,b=0.11V,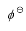 =1.36V,请计算实际的分解电压。
=1.36V,请计算实际的分解电压。
第5题
第6题
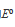 是( )V。
是( )V。A.-2.38
B.-1.70
C.-1.02
D.+1.70
第7题
已知反应
2Cr3++3Cl2+7H2O=Cr2O72-+6C1-+14H+
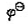 (Cr2O72-/Cr3+)=1.33V,
(Cr2O72-/Cr3+)=1.33V,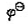 (Cl2/CI-)=1.36V,F=95500J·V-1·mol-2若在298K时组成原电池。
(Cl2/CI-)=1.36V,F=95500J·V-1·mol-2若在298K时组成原电池。
(1)写出该原电监的电池符号,并计算标准电动势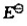 ;(2)计算
;(2)计算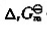 (298K)并判断反应进行的方向;(3)计算标准平衡常数
(298K)并判断反应进行的方向;(3)计算标准平衡常数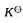 ;(4)若c(H+)=10mol·dm-3,其他离子浓度均为标准浓度,求原电池的电动势E并判断反应进行的方向
;(4)若c(H+)=10mol·dm-3,其他离子浓度均为标准浓度,求原电池的电动势E并判断反应进行的方向
第9题