 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
试说明钾原子中电子的排列方式,并和钠元素的化学性质进行比较。
 答案
答案
 请输入或粘贴题目内容
搜题
请输入或粘贴题目内容
搜题
 拍照、语音搜题,请扫码下载APP
拍照、语音搜题,请扫码下载APP
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 答案
答案
 更多“试说明钾原子中电子的排列方式,并和钠元素的化学性质进行比较。”相关的问题
更多“试说明钾原子中电子的排列方式,并和钠元素的化学性质进行比较。”相关的问题
第1题
A.随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大
B.碱金属元素中,锂原子失去最外层电子的能力最弱;卤素中,氟原子得电子的能力最强
C.钾与水的反应比钠与水的反应更剧烈
D.碱金属元素的单质都可以保存在煤油中
第3题
A.元素的电负性:P<O<F
B.元素的第一电离能:C<N<O
C.离子半径:O2->Na+>Mg2+
D.原子的未成对电子数:Mn>Si>Cl
第4题
有一种简化的“一维氦原子”模型,原子核一电子以及电子-电子间的作用势均用δ势阱(垒)表示,总能量算符取为
(1)
其中x1、x2表示电子1和2的坐标,Ze是原子核电荷.如采用自然单位,即距离以a0/Z为单位(a0是Bohr半径),能量以Z2e2/a0为单位,则H可以简化成
(2)
如视电子-电子作用势(上式中最后一项)为微扰,试求体系的能级(一级近似),并和三维氦原子的微扰论结果比较.
第6题
A.从氟到碘,其氢化物的稳定性逐渐减弱
B.因为铝原子比钠原子失去电子数目多,所以铝比钠的还原性强
C.第三周期从钠到氯,最高价氧化物对应的水化物碱性逐渐减弱,酸性逐渐增强
D.氧与硫为同主族元素,氧比硫的原子半径小,氧比硫的非金属性强
第7题
A.有机物分子中,碳原子间只能排列成链状
B.碳原子有4个价电子,可与其他原子形成4个共价键
C.组成有机物的元素种类较多
D.碳原子间可以有多种排列方式
第8题
简要回答下列问题:
(1)电解NaCl熔盐制取金属Na的过程中,为什么要加入CaCl2?由此带来的负面影响是什么?
(2)为什么金属Mg与冷水反应极慢,却可以迅速与热水或NH4Cl水溶液发生反应?
(3)什么是离子势φ?为什么φ的大小可以影响一些氧化物的水化物的解离方式?
(4)为什么加热MgCl2·6H2O时得不到无水盐?
(5)为降低煤炭燃烧时排向大气的SO2量,可以把CaO或CaCO3掺到含硫的煤炭中。试说明这种做法的化学原理,写出相关的化学反应方程式。
(6)Li+和Mg2+半径十分接近,试分析它们的碳酸盐分解温度的高低。
(7)锂的第一电离能比钠大,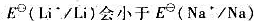 ?既然
?既然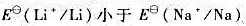 ,为什么锂与水的反应却不如钠剧烈?
,为什么锂与水的反应却不如钠剧烈?
(8)试说明锂的哪些性质与镁相似而有别于钠、钾。
(9)试说明铍的哪些性质与铝相似而有别于镁、钙。
(10)试用价层电子对互斥理论和杂化轨道理论,讨论XeF6分子的几何构型和中心原子的轨道杂化方式。
第9题
第10题
斯莱特(Slater)规则指出:同层电子的σ=0.35(对于1s轨道电子,则σ=0.30);若被屏蔽的电子为ns或np时,则(n-1)层电子的σ=0.85,更内层电子的σ=1.00。考虑屏蔽效应后,电子的能量可用下式近似计算:
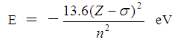
试分别计算在原子序数为12,16,25的元素原子中,4s和3d轨道哪个能量高?从计算结果可得出什么结论?