 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知(Ag+/Ag)=0.79V,(Fe2+/Fe)=-0.41V,则反应 逆向自发进行。 ()
已知

 逆向自发进行。 ( )
逆向自发进行。 ( )
 答案
答案
 请输入或粘贴题目内容
搜题
请输入或粘贴题目内容
搜题
 拍照、语音搜题,请扫码下载APP
拍照、语音搜题,请扫码下载APP
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
已知

 逆向自发进行。 ( )
逆向自发进行。 ( )
 答案
答案
 更多“已知(Ag+/Ag)=0.79V,(Fe2+/Fe)=-0.41V,则反应 逆向自发进行。 ()”相关的问题
更多“已知(Ag+/Ag)=0.79V,(Fe2+/Fe)=-0.41V,则反应 逆向自发进行。 ()”相关的问题
第1题
已知EΘ(Ag+/Ag)=0.799V,AgBr的Ksp=5.35×10-13,则EΘ(AgBr/Ag)=________V。
第2题
第3题
在0.01mol·L-1[Ag(NH3)2]+溶液中,含有过量的0.01mol·L-1氨水,计算溶液中的Ag+浓度。已知Kf([Ag(NH3)2]+)=1.6×107。
第4题
在1mL 0.04mol·L-1AgN03溶液中,加入1mL 2.00mol·L-1氨水,计算平衡后溶液中的Ag+浓度。已知Kf([Ag(NH3)2]+)=1.6×107。
第5题
将一块纯铜片置于0.050mol/L AgNO3溶液中,计算溶液达到平衡后的组成。已知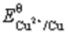 (Cu2+/Cu)=0.337V,
(Cu2+/Cu)=0.337V,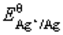 (Ag+/Ag)=0.80V。(提示:首先计算出反应平衡常数。)
(Ag+/Ag)=0.80V。(提示:首先计算出反应平衡常数。)
第6题
已知φ(Ag+/Ag)=0.7996V,φ(Cu2+/Cu)=0.3419V,室温下将过量铜粉置入0.1mol·L-1的AgNO3溶液中,平衡时溶液中Cu2+浓度为()。
A.0.1mol·L-1
B.0.001mol·L-1
C.0.05mol·L-1
D.0.01mol·L-1
第7题
在298K时,下述电池的电动势E=0.1519V:
Ag(s)|AgI(s)|HI(a=1)|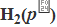 |Pt
|Pt
并已知下列物质的标准摩尔生成焓:
| 物 质 | AgI(s) | Ag+ | I- |
 | -62.38 | 105.89 | -55.94 |
试求:

第8题
298K时,在Ag+/Ag电极中加入过量I-,设达到平衡时c(I-)=0.1mol·dm-3,而另一电极为Cu2+/Cu,c(Cu2+)=0.01mol·dm-3,将两电极组成原电池,写出原电池符号、电池反应,并求电池反应平衡常数。
已知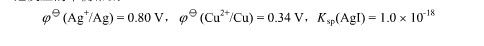
第9题
298K时,Ag(s)|Ag+(a)的标准电极电势EΘ=0.799V,反应Fe3+(a2)+Ag(s)→Fe2+(a3)+Ag+(a1)的平衡常数KΘ=0.531,试求
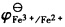 。
。
第10题
由于


