 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
298K时,Ag(s)|Ag+(a)的标准电极电势EΘ=0.799V,反应Fe3+(a2)+Ag(s)→Fe2+(a3)+Ag+(a1)的平衡常数KΘ
298K时,Ag(s)|Ag+(a)的标准电极电势EΘ=0.799V,反应Fe3+(a2)+Ag(s)→Fe2+(a3)+Ag+(a1)的平衡常数KΘ=0.531,试求
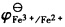 。
。
 答案
答案
题中反应设计的电池为
Ag(s)|Ag+(a1)||Fe3+(a2)Fe2+(a3)|Pt
负极 Ag(s)→Ag+(a1)+e-
正极 Fe3+(a2)+e-→Fe2+(a3)
电池反应 Fe3+(a2)+Ag(s)→Fe2+(a3)+Ag+(a1)
已知平衡常数与标准电池电动势之间的关系为

题中反应设计的电池为Ag(s)|Ag+(a1)||Fe3+(a2),Fe2+(a3)|Pt负极Ag(s)→Ag+(a1)+e-正极Fe3+(a2)+e-→Fe2+(a3)电池反应Fe3+(a2)+Ag(s)→Fe2+(a3)+Ag+(a1)已知平衡常数与标准电池电动势之间的关系为





 (AgCl,s)=-109.79kJ·mol-1,
(AgCl,s)=-109.79kJ·mol-1, =0.799V,
=0.799V, =0.373V,试计算Ag(NH3)2;的络合平衡常数
=0.373V,试计算Ag(NH3)2;的络合平衡常数




















