 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
用0.1000mol/LNaOH滴定下列酸能产生两个滴定突跃的是()。
A.丁二酸(Ka1=6.21×10-5,Ka2=2.31×106)
B.亚磷酸(Ka1=3.0×10-2,Ka2=1.62×10-7)
C.酒石酸(Ka1=9.2×10-4,Ka2=4.31×10-5)
D.马来酸(Ka1=1.23×10-2,Ka2=4.66×10-7)
 答案
答案
 请输入或粘贴题目内容
搜题
请输入或粘贴题目内容
搜题
 拍照、语音搜题,请扫码下载APP
拍照、语音搜题,请扫码下载APP
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
A.丁二酸(Ka1=6.21×10-5,Ka2=2.31×106)
B.亚磷酸(Ka1=3.0×10-2,Ka2=1.62×10-7)
C.酒石酸(Ka1=9.2×10-4,Ka2=4.31×10-5)
D.马来酸(Ka1=1.23×10-2,Ka2=4.66×10-7)
 答案
答案
 更多“用0.1000mol/LNaOH滴定下列酸能产生两个滴定突跃的是()。”相关的问题
更多“用0.1000mol/LNaOH滴定下列酸能产生两个滴定突跃的是()。”相关的问题
第1题
取同量KIO3·HIO3溶液,其一直接用0.1000mol/LNaOH滴定,耗用NaOHV(mL);其二溶液酸化后,加入过量KI,以Na2S2O3标液滴定,用去4V(mL),则c(Na2S2O3)=______mol/L。
第2题
取酒石酸(H2C4H4O6)与甲酸(HCOOH)混合液10.00mL,用0.1000mol/LNaOH滴定至C4H4O62-与HCOO-,耗去15.00mL。另取10.00mL混合液,加入0.2000mol/L Ce(N)溶液30.00mL,在强酸性条件下,酒石酸和甲酸全部被氧化成CO2,剩余的Ce(Ⅳ)用0.1000mol/L Fe(Ⅱ)回滴,耗去10.00mL。计算混合液中酒石酸和甲酸的浓度。[提示:Ce(Ⅳ)的还原产物为Ce(Ⅲ)。]
第3题
准确量取30.00ml弱酸HA,加水稀释至100ml,在下列电池中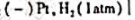
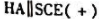 为测定电池,以0.1000mol/LNaOH溶液滴定弱酸HA溶液。当酸被中和一半时,电池电动势为0.524V;化学计量点时,电池电动势为0.749V。(1)计算弱酸HA的Ka;(2)原弱酸HA的浓度是多少?(φSCE=0.242V)。
为测定电池,以0.1000mol/LNaOH溶液滴定弱酸HA溶液。当酸被中和一半时,电池电动势为0.524V;化学计量点时,电池电动势为0.749V。(1)计算弱酸HA的Ka;(2)原弱酸HA的浓度是多少?(φSCE=0.242V)。
第4题
准确量取30.00ml弱酸,加水稀释至100ml。以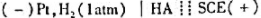 为测定电池,以0.1000mol/LNaOH溶液滴定弱酸HA。当酸被中和一半时,电池电动势为0.524V;化学计量点时,电池电动势为0.749V。φSCE=0.242V。计算:
为测定电池,以0.1000mol/LNaOH溶液滴定弱酸HA。当酸被中和一半时,电池电动势为0.524V;化学计量点时,电池电动势为0.749V。φSCE=0.242V。计算:
(1)弱酸HA的Ka。
(2)原弱酸HA的浓度。
第5题
水]的数据:
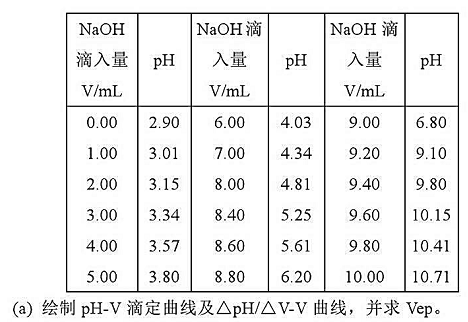
(b)用二阶微商法计算Vep,并与(a)的结果比较.
(c)计算弱酸的浓度.
(d)化学计量点的pH值应是多少?
第6题
用0.1000mol/L NaOH滴定0.1000mol/L H3AsO4,能滴定到哪一步?计量点pH为多少?
第7题
用0.1000mol/L NaOH滴定20.00mL HCOOH溶液(0.1000mol/L),HCOOH的Ka=1.8×10-4,求:
第8题
用0.1000mol·L-1NaOH分别滴定0.1000mol·L-1HCl和0.1000mol·L-1HAc,其突跃范围是相同的。( )
第9题
A.4.30~6.24
B.4.30~9.70
C.5.30~8.70
D.6.30~7.70
第10题
用0.1000mol/LHCl溶液滴定0.1000mol/LNa2CO3溶液至pH5.00。计算有百分之几的Na2CO3变成了H2CO3?剩下的主要组分是什么?如果煮沸溶液以除尽CO2,冷却后溶液的pH为多少?(H2CO3的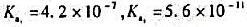 )
)
第11题
A.3.30~10.70
B.4.30~9.70
C.5.30~8.70
D.5.30~9.70