 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
计算Cu2+的浓度为0.001mol·L-1时,电对Cu2+/Cu的电极电势。已知(Cu2+/Cu)=+0.337V。
计算Cu2+的浓度为0.001mol·L-1时,电对Cu2+/Cu的电极电势。已知
 答案
答案
 请输入或粘贴题目内容
搜题
请输入或粘贴题目内容
搜题
 拍照、语音搜题,请扫码下载APP
拍照、语音搜题,请扫码下载APP
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
计算Cu2+的浓度为0.001mol·L-1时,电对Cu2+/Cu的电极电势。已知
 答案
答案
 更多“计算Cu2+的浓度为0.001mol·L-1时,电对Cu2+/Cu的电极电势。已知(Cu2+/Cu)=+0.337V。”相关的问题
更多“计算Cu2+的浓度为0.001mol·L-1时,电对Cu2+/Cu的电极电势。已知(Cu2+/Cu)=+0.337V。”相关的问题
第1题
已知φ(Ag+/Ag)=0.7996V,φ(Cu2+/Cu)=0.3419V,室温下将过量铜粉置入0.1mol·L-1的AgNO3溶液中,平衡时溶液中Cu2+浓度为()。
A.0.1mol·L-1
B.0.001mol·L-1
C.0.05mol·L-1
D.0.01mol·L-1
第2题
金属离子Fe2+、Cu2+、Al3+、Mn2+浓度均为0.01mol/L,计算各离子开始沉淀为氢氧化物和沉淀完全的pH。已知 =8.0×10-16,
=8.0×10-16, =2.6×10-19,
=2.6×10-19, =4.6×10-33,
=4.6×10-33, =1.9×10-13。
=1.9×10-13。
第5题
电池Zn|Zn2+(c=?)||Cu2+(0.02mol·L-1)|Cu,其电动势为1.06V,计算Zn2+浓度。已知 (Zn2+/Zn)=-0.763V,
(Zn2+/Zn)=-0.763V,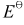 (Cu2+/Cu)=0.337V。
(Cu2+/Cu)=0.337V。
第6题
计算原电池(一)Cu|Cu2+(1.0 mol·kg-1)||Ag+(1.0 mol·kg-1)|Ag()在下述情况下电动势改变值:(1)Cu2+浓度降到1.0X10-3mol·kg-1(2)加入足量的CI-使AgCl沉淀,设CI-浓度为1.561 mol·kg-1
第7题


已知c(
第8题
在pH=9.26的氨性缓冲溶液中,除氨络合物外的缓冲剂总浓度为0.20mol·L-1,游离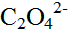 浓度为0.10mol·L-1。计算Cu2+的αCu。已知Cu(Ⅱ)-
浓度为0.10mol·L-1。计算Cu2+的αCu。已知Cu(Ⅱ)-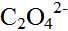 络合物的lgβ1=4.5,lgβ2=8.9;Cu(Ⅱ)-OH-络合物的lgβ1=6.0。
络合物的lgβ1=4.5,lgβ2=8.9;Cu(Ⅱ)-OH-络合物的lgβ1=6.0。
第9题
pH=6且含0.001mol/L的Zn2+缓冲溶液50mL,用100mL 0.05mol/L的C9H7NO(8-羟基喹啉)的乙醚溶液萃取,两相分离以后,用原子吸收光谱法测定,已有90%的Zn2+离子被萃取,计算Zn-8羟基喹啉配合物在这个体系中的分配比。
第10题