 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
100mL 0.100mol/L HA弱酸溶液,用25.0mL乙醚萃取,萃取后取出25.0mL水相,需20.0mL0.0500mol/L NaOH溶液与之中
 答案
答案
 请输入或粘贴题目内容
搜题
请输入或粘贴题目内容
搜题
 拍照、语音搜题,请扫码下载APP
拍照、语音搜题,请扫码下载APP
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
 答案
答案
 更多“100mL 0.100mol/L HA弱酸溶液,用25.0mL乙醚萃取,萃取后取出25.0mL水相,需20.0mL0.0500mol/L NaOH溶液与之中”相关的问题
更多“100mL 0.100mol/L HA弱酸溶液,用25.0mL乙醚萃取,萃取后取出25.0mL水相,需20.0mL0.0500mol/L NaOH溶液与之中”相关的问题
第1题
欲配制Na2C2O4标准溶液用于标定KMnO4溶液(在酸性介质中),已知c(KMnO4)≈0.100mol/L,若要使标定时两种溶液消耗的体积相近,问应配制多大浓度的Na2C2O4溶液?要配制100mL溶液,应称取Na2C2O4多少克?
第2题
准确量取30.00ml弱酸HA,加水稀释至100ml,在下列电池中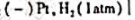
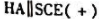 为测定电池,以0.1000mol/LNaOH溶液滴定弱酸HA溶液。当酸被中和一半时,电池电动势为0.524V;化学计量点时,电池电动势为0.749V。(1)计算弱酸HA的Ka;(2)原弱酸HA的浓度是多少?(φSCE=0.242V)。
为测定电池,以0.1000mol/LNaOH溶液滴定弱酸HA溶液。当酸被中和一半时,电池电动势为0.524V;化学计量点时,电池电动势为0.749V。(1)计算弱酸HA的Ka;(2)原弱酸HA的浓度是多少?(φSCE=0.242V)。
第4题
分别计算0.100mol/L KMnO4和0.100mol/L K2Cr2O7在H+浓度为1.0mol/L介质中还原一半时的电位。计算结果说明什么?已知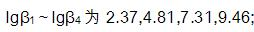 ,
,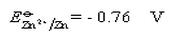
第5题
将0.100molI2溶解在1.00L 0.100mol/L KI溶液中而得到I3-溶液。I3-生成反应的Kc值为0.752,求I3-溶液中I2的浓度。
第6题
A 100mL portion of a 0.1000mol·L-1aqueous solution of the weak acid HA is extracted with 50.00mL of CCl4. After the extraction,a 25.00mL aliquot of the aqueous phase was titrated with 10.00mL of a 0.1000mol·L-1NaOH. Calculate the distribution ratio of HA.
第7题
若将等体积的0.200mol/LEDTA溶液和0.100mol/L Mg(NO3)2溶液混合,问在pH=9.0的条件下,未配位的Mg2+的浓度为多少?
第8题
准确量取30.00ml弱酸,加水稀释至100ml。以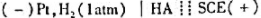 为测定电池,以0.1000mol/LNaOH溶液滴定弱酸HA。当酸被中和一半时,电池电动势为0.524V;化学计量点时,电池电动势为0.749V。φSCE=0.242V。计算:
为测定电池,以0.1000mol/LNaOH溶液滴定弱酸HA。当酸被中和一半时,电池电动势为0.524V;化学计量点时,电池电动势为0.749V。φSCE=0.242V。计算:
(1)弱酸HA的Ka。
(2)原弱酸HA的浓度。
第9题
于0.100mol/LFe3+和0.250mol/LHCl混合溶液中,通入H2S气体使之达到平衡,求此时溶液中Fe3+的浓度。已知H2S饱和溶液的浓度为0.100mol/L;φ0(S/H2S)=0.141V;φ0(Fe3+/Fe2+)=0.71V。
第10题
释至100mL,测得此溶液的pH为5.25,问此一元弱酸(HA)的Kθa值是多少?